山争(峥)哥哥与年轻导演文牧野又一次引发了电影圈的大地震,上映9天,《我不是药神(Dying To Survive)》票房就已经破了20亿,其剧中涉及的白血病人的现实问题引起了社会广泛关注:
一位不速之客的意外到访,打破了神油店老板程勇的平凡人生,他从一个交不起房租的男性保健品商贩,一跃成为印度仿制药“格列宁”的独家代理商。收获巨额利润的他,生活剧烈变化,被病患们冠以“药神”的称号。但是,一场关于救赎的拉锯战也在波涛暗涌中慢慢展开......
观影指南:你该知道这些名词
鉴于部分粉丝还未观影,尚普君(ID:ipobank)附一则观影指南,不涉及剧透:
1、 纸巾:到影片后半段你会听到周围的人都在哭
2、 CML:Chronic Myelocytic Leukemia,慢性髓细胞白血病,是我国慢性白血病的主要病种,约占慢性白血病的70%,大多数病例经慢性期、加速期,最后进入急变期转化为急性白血病而死亡。
3、 仿制药:在原研药专利到期后,复制粘贴原研药,是真药
与商品名药在剂量、安全性和效力(strength)(不管如何服用)、质量、作用(performance)以及适应症(intended use)上相同的一种仿制品(copy),是与原研药具有相同的活性成分、剂型、给药途径和治疗作用的药品。
4、 原研药/专利药/创新药:可以理解为正版药
凡申请专利的新化学单体药为专利药,它研制过程包括发现阶段、临床前开发、新药临床前申请(IND)、新药临床试验I期、新药临床试验Ⅱ期、新药临床试验Ⅲ期、新药申请(NDA)。这些药品只有拥有这些专利药品的公司才能生产,或由他们自己转让别人生产。
5、 一致性评价:仿制药一致性评价是指对已经批准上市的仿制药,按与原研药品质量和疗效一致的原则,分期分批进行质量一致性评价,就是仿制药需在质量与药效上达到与原研药一致的水平。美国FDA规定,仿制药必须和它仿的专利药在“有效成分、剂量、安全性、效力、作用(包括副作用)以及针对的疾病上都完全相同”。
6、 格列卫:电影中称为格列宁,是甲磺酸伊马替尼的商品名,是国际医药巨头诺华公司研发的针对慢性粒细胞白血病(CML)的小分子靶向药。伊马替尼的出现颠覆了传统的治疗方案,使患病者5 年生存率达到93%,相比于最初的治疗方案马利兰等,患者生存率显著提升。对于患者而言,伊马替尼成为维系生命的必需品。
原研药上市:高投入高风险长周期
剧中的矛盾,主要源自于原研药格列宁的定价过高,而普通大众由于需长期服用,因买药很容易倾家荡产。
原研药之所以定价如此高昂,用一句俗语来解释就是“第一粒药品的价格是50亿美元,第二粒药品的价格只有5美元”。原研药的研发周期长达十几年,资金投入十分巨大,且研发失败率高,一旦失败,颗粒无收。
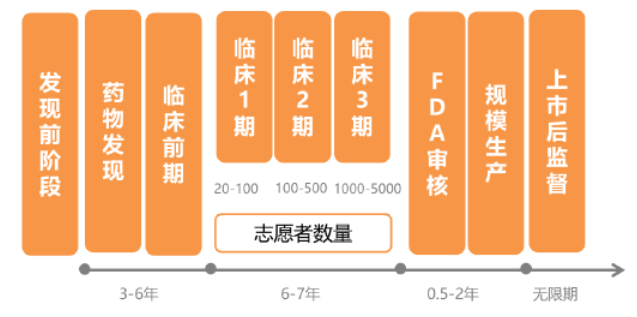
国际制药巨头每年都投入上百亿美元的研发费用,例如辉瑞制药,2017年,其营业收入达到525亿美元,其中光研发投入就有76亿美元,占到收入的15%。新基医药2017年营收130亿美元,研发投入59亿美元,占到45%。可气的是,高投入并不一定有高回报,药物研发成功的概率奇低,肿瘤药物又格外突出,整体成功率仅有5%。商人不是慈善家,在这种背景下,如果没有专利期保护政策,将没有医药企业愿意进行如此耗精力的药物研发活动。
仿制药:印度成全球药房
程勇为吕受益等白血病人代购的国家,就是印度,是出了名的仿制药生产大国。
仿制药概念始于1984 年的美国“Hatch-Waxman 法案”,法案规定,只要新厂家证明自己的产品与原研药生物活性相当便可仿制。而印度仿制药如此发达,主要归因于印度政府的支持。
1960 年刚成立的兰伯西(Ranbaxy)仿制罗氏的镇定剂苯甲二氮Valium,为穷人提供了新的购药渠道,解决了印度好药匮乏的问题。
1970年印度政府出台《专利法》,将原有的产品专利保护转变为工艺专利保护;规定"只保护制药工艺,不保护药品成分",对食品、药品等只授予工艺专利,不授予产品专利,使印度制药企业可以合法仿制跨国医药企业的原研药。
1994 年,印度签署了《与贸易有关的知识产权协定》(TRIPS 协议)。协议给予了发展中国家10 年过渡期。在这一时期内,印度接受医药产品专利申请,但仍不授予医药产品专利保护。印度药企逐渐确立了竞争优势,并开始进入国际市场。
2005年之后,专利制度逐渐与国际接轨,本土企业专利制度优势减弱,促进了本土医药企业创新与研发,跨国合作加速。2012 年,印度发布了《生物制剂类似物标准指南》,对质量,流程与试验审批等做出了规范。
中国政府在努力:解决天价药问题
2015 年以前,我国药政监管领域面临诸多积弊,药品审评批件积压现象严重,药品上市周期过长,许多同类靶点药物与发达国家上市时间相隔5-10 年,导致临床需求远远得不到满足。
2015 年以来,《国家食品药品监督管理总局关于开展药物临床试验数据自查核查工作的公告》打响药政改革的第一枪,政府逐步对药品准入监管进行了全方位的改革和制度化构建。
2016 年3 月,国务院办公厅发布《关于开展仿制药质量和疗效一致性评价的意见》,对于已经通过一致性评价的品种,在医保支付、招标过程中享受政策红利,在江苏、山东、四川等多个省份“通过一致性评价的品种”与原研分到了一个竞价分组,以期可以替换原研药或者促进原研药降价。
2017 年10 月,国务院《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》的出炉以及后续《药品管理法》修正案、《药品注册管理办法》两个征求意见稿的出台,从顶层设计的角度对接下来的药政改革进行了方向性的指导。
2017 年我国医保目录在历时8 年后,再次进行了调整。新版医保目录扩大了基本医疗保险用药保障范围,中成药、西药部分共收载药品2535 个,相较于2009 年,新版医保目录新增339个品种,关注儿童用药和重大疾病用药,增加职业病特殊用药等,电影中所指的格列卫正是在这次医保目录调整中进入的国家医保。
同时,为了进一步加大高价值药品的覆盖,对于更多的临床价值高的新药等采取国家谈判的方式。2016 年和2017 年分别由卫计委和人社部开展了两次国家医保目录谈判,通过谈判降价的方式纳入这些高临床价值的药品。
中国医药行业:仿制药还是原研药?
仿制药的存在,一方面为普通民众提供了价格更低但药效相同的药物,切实减轻了大众的患病负担;但另一方面,在一定程度上降低了药企研发的积极性,毕竟,只要专利期一过,药企就可以通过生产仿制药,凭借极低的成本获取高额利润。
但是,真实的临床需求刺激了创新产品的供给,最终回到需求,本质上是一个螺旋上升的正向循环。CFDA 准入制度的改革和未来医保动态调整机制的实现从制度的角度打开了循环过程中的瓶颈,从供给和支付端都逐步打开了原研药的市场,使得整个产业以更快的速度螺旋上升。同时叠加上产业本身从技术层面的日新月异,国内处在转折点上的医药制造业行业属性正逐步由迭代速度较慢的制造业逐步转为迭代速度更快的高新技术行业。
至于医药行业到底是选择原研药还是仿制药,并不是一个单选题,左手原研,右手仿制,两手都要抓,两手都要硬,才能在现阶段和以后的日子里,真正的为人民谋福祉。

北京公司:海淀区北四环中路229号海泰大厦1118、1120、1127、1129室
市场调研:010-82885719 投资咨询:010-82885739 IPO咨询:13552565382
上海公司:黄浦区延安东路45号工商联大厦717室
市场调研:021-61397134 投资咨询:021-64023562 IPO咨询:13611322396
广州公司:天河区珠江新城华夏路30号富力盈通大厦41层 电话:020-84593416 13527831869
深圳公司:福田区深南大道2008号凤凰大厦2栋26C1室 电话:18148563314
尚普咨询集团有限公司 版权所有 京ICP备08011146号-6 国统涉外证字第1690号
Copyright @ 2008-2023 Shangpu-China.Com All Rights Reserved